Biologie Das Plastikbakterium
Der ideale Biokunststoff wird nachhaltig produziert und ist kompostierbar. Cyanobakterien könnten ihn herstellen. Auf dem Weg zu seiner industriellen Produktion muss man aber tief in die biotechnologische Trickkiste greifen
Wir leben im Zeitalter des Plastiks. Unzählige Dinge, die uns tagtäglich umgeben, sind daraus hergestellt. Auch wer nachhaltig einkaufen will, muss feststellen, dass nahezu alle Waren in Plastik verpackt sind. Das Gewissen plagt, doch gibt es kaum Alternativen. Den größten Teil nutzen wir tatsächlich für Verpackungen. Das bedeutet: Mehr als 40 Prozent der weltweit hergestellten Kunststoffe werfen wir gleich nach dem Kauf weg.
Da das Recycling von Kunststoffen oft aufwendig ist, wird der Großteil „thermisch verwertet“, auf gut Deutsch: verbrannt. Und weil Plastik überwiegend aus Erdöl hergestellt wird, setzt dessen Verbrennung CO2 frei – und befeuert so den Klimawandel. Verpackungen, die nicht sachgerecht entsorgt werden, gelangen allzu leicht in die Umwelt. Dort dauert es bis zu einige hundert Jahre, bis sie sich zersetzen – sie gefährden unsere Ökosysteme. Besonders bedrückend sind die riesigen Müllinseln im Pazifischen Ozean. Diese wachsen stetig und werden die Folgen unseres Konsumverhaltens noch weit über unsere Lebenszeit hinaus bezeugen.
Um das Problem in den Griff zu bekommen, setzt die Industrie auf sogenanntes Bioplastik. Der Sammelbegriff steht für Kunststoffe, die aus nachwachsenden Rohstoffen hergestellt werden und biologisch abbaubar sind. In der Theorie ist das eine gute Idee, in der Praxis werden diese aber häufig aus Lebensmitteln wie Mais hergestellt – was aus ethischer Sicht problematisch ist. Darüber hinaus sind derzeit verfügbare Biokunststoffe häufig nur schlecht und im Wasser oft gar nicht abbaubar. Ein Fall von klassischem „Greenwashing“ also, das Verbraucherinnen und Verbrauchern zwar ein gutes Gewissen vermittelt, aber der Umwelt kaum hilft.

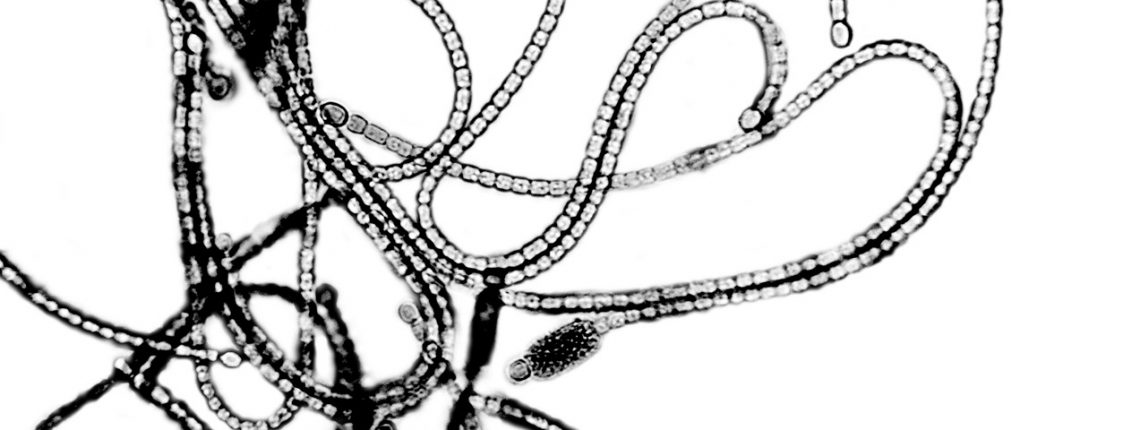
Nun kommen kleine, grüne Einzeller ins Spiel: Cyanobakterien. Sie können fast ausschließlich mithilfe von Sonnenlicht und dem Kohlendioxid aus der Atmosphäre gedeihen. Sie betreiben also, ähnlich wie Algen, Photosynthese. Nebenbei produzieren sie auch eine ganz besondere Substanz: Polyhydroxybutyrat, kurz PHB. Dieser Stoff lagert sich unter bestimmten Bedingungen in den Einzellern in Form kleiner Kugeln ein. Er hat ähnliche Materialeigenschaften wie Polypropylen, einem der häufigsten Standardkunststoffe für Verpackungen. Aber im Gegensatz zu diesem ist er gut biologisch abbaubar. Da die Cyanobakterien zur Produktion dieses PHB den Kohlenstoff aus dem Treibhausgas CO2 nutzen, ist die Herstellung sogar besonders nachhaltig. Die Cyanobakterien können in Bioreaktoren gezüchtet werden, benötigen somit keine kostbare Nutzfläche und stehen nicht in Konkurrenz zur Nahrungsmittelproduktion.
Bedauerlicherweise nehmen die PHB-Kugeln aber nur etwa zehn Prozent der Cyanobakterienzelle ein, die Herstellungskosten sind deshalb hoch. Unsere Arbeitsgruppe an der Universität Tübingen wollte deshalb zunächst den Stoffwechsel der Cyanobakterien besser verstehen, um ihn anschließend gezielt für die PHB- Produktion zu optimieren. Wir träumten davon, dass wir die Einzeller dazu bringen können, große Mengen Biokunststoff herzustellen. Doch an diesem „Plastikbakterium“ haben sich bereits viele Forschende versucht – und sind bislang immer gescheitert.
Man kann sich die Stoffwechselprozesse innerhalb einer Zelle wie ein dichtes Straßennetz vorstellen, auf dem der Kohlenstoff durch die Zelle rauscht. Unterwegs werden die Kohlenstoffmoleküle von Enzymen immer weiter verändert, sodass aus dem ursprünglichen CO2 am Ende PHB wird. Dabei gibt es Kreuzungen, an denen Moleküle abzweigen können und so zu anderen Produkten werden. Es gibt auch Ampeln, kleine und große Straßen, manchmal auch Sackgassen. Wir wollten wissen, welchen Weg jener Kohlenstoff nimmt, der am Ende im PHB gebunden wird. Könnten wir dieses Geheimnis lüften, wäre es uns vielleicht auch möglich, diesen Weg zu beschleunigen oder zu verkürzen. So könnten wir den Produktionsprozess gezielt effektiver machen.
Um zu testen, welche dieser Stoffwechselwege für die PHB-Produktion relevant sind, „blockierten“ wir die verschiedenen Wege einen nach dem anderen, errichteten also gewissermaßen Straßensperren in der Zelle. Dazu nutzten wir einen molekularbiologischen Trick: Nach und nach schnitten wir die Gene aus, die für wichtige Enzyme dieser Stoffwechselwege codieren. War ein bestimmter Weg für die PHB-Produktion wichtig, konnte kein Kohlenstoff mehr über diesen Weg gelangen, und die Zelle produzierte weniger PHB. War der Weg hingegen für die PHB-Synthese unwichtig, blieb die produzierte PHB-Menge auch dann unverändert, wenn dieser Weg blockiert war. Auf diese Weise fanden wir heraus, dass der Stoffwechselweg der Glykolyse eine entscheidende Rolle spielt.
Nun konnten wir versuchen, diesen gezielt zu regulieren. Dabei war uns der Zufall behilflich: Wir entdeckten nämlich ein sogenanntes Regulatorprotein, das wie eine Ampel eine entscheidende Kreuzung steuert. Ist dieses Protein vorhanden, steht die Ampel auf Rot. Der Kohlenstofftransport ist unterbunden, es kann kein PHB erzeugt werden. Wir schnitten daraufhin das Gen für ebendieses Regulatorprotein aus dem genetischen Bauplan der Zelle heraus. Es wurde nun nicht mehr gebildet, und die Ampel sprang auf Grün. So gelang es uns tatsächlich, den gestoppten Kohlenstoff von nun an in Richtung PHB fließen zu lassen.
Doch es gab eine weitere Hürde: Das letzte Stück des Weges zur PHB-Synthese glich eher einem Trampelpfad als einer Autobahn. Hier arbeiteten die Enzyme so langsam, dass nur wenig vom Kohlenstoff in PHB umgewandelt wurde. Was wir wussten: Anders als in unserem Cyanobakterium läuft dieser Prozess im Einzeller namens Cupriavidus necator viel effizienter. Wir übertrugen daher dessen Gene für die schnellen Enzyme in unser Cyanobakterium – und bauten auf diese Weise auch das letzte Wegstück zur Schnellstraße aus.
Mit Erfolg. Im Gegensatz zu den natürlich vorkommenden Cyanobakterien, die ungefähr 10 Prozent PHB einlagern, bestehen unsere neuen Stämme aus über 80 Prozent aus dem Biokunststoff. Das „Plastikbakterium“ ist Realität geworden.
Bislang funktioniert das Ganze freilich nur unter Laborbedingungen. Deswegen arbeiten wir bereits mithilfe eines Investors an einer industriellen Produktion. Wir würden gern in fünf bis zehn Jahren im großen Maßstab Kunststoffe für den Markt bereitstellen – um so eine nachhaltige Lösung für die globale Plastikverschmutzung anzubieten.
Wie Öko kann Plastik sein?
Noch enttäuscht die Nachhaltigkeit sogenannter Biokunststoffe
Weltweit werden jährlich über 400 Millionen Tonnen Kunststoffe produziert – rund 40 Prozent davon sind bereits nach einem Monat Abfall. Dieser eine Fakt bringt eines der größten Umweltprobleme auf den Punkt. Gelangt Kunststoff zerrieben und zerkleinert in die Meere, werden die Mikropartikel von Fischen aufgenommen und gelangen am Ende auch auf unsere Teller.
Deshalb läuft die Entwicklung sogenannter Biokunststoffe auf Hochtouren. Der Begriff steht zum einen für solche Kunststoffe, die nicht aus Erdöl, sondern aus pflanzlichen Rohstoffen hergestellt werden. Zum anderen findet sich die Bezeichnung auf Produkten, die biologisch abbaubar sind. Allerdings: Nur weil Kunststoffe aus Zuckerrohr, Mais oder Bambus hergestellt wurden, sind sie nicht grundsätzlich auch biologisch abbaubar. Umgekehrt gibt es erdölbasierte Kunststoffe, die biologisch abbaubar sind.
Überdies beantwortet das Umweltbundesamt die Frage, ob biobasierte Kunststoffe nachhaltiger sind als konventionelle Kunststoffe mit: „Eher nein.“ Denn der Anbau geeigneter Pflanzen in großem Maßstab geht mit zahlreichen anderen Umweltgefährdungen wie Flächenverbrauch und Gewässerversauerung einher.
Diese Probleme entfielen weitgehend, wenn Cyanobakterien Biokunststoffe allein aus der Energie der Sonne und dem CO2 aus der Luft produzierten. Karl Forchhammer von der Universität Tübingen, der auch die Doktorarbeit von Moritz Koch betreute, ist überzeugt, dass Mikroorganismen eines Tages kompostierbares Bioplastik produzieren und dabei sogar etwas für den Klimaschutz tun. Auch könnte man die Anlagen auf Flächen bauen, die für nichts anderes zu nutzen sind. — JS

